Entstehung, Diagnose und Behandlung
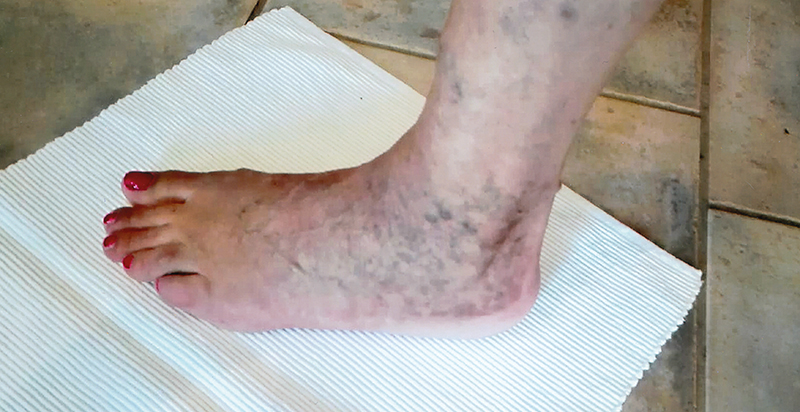
Bei der Atrophie blanche handelt es sich um eine Entzündung der Endgefäße der Arterien (Arteriolitis) meistens als Folge einer lokalisierten chronischen-venösen Insuffizienz (CVI) im Stadium II und III vor allem in der medialen perimalleolären Region, der inneren Knöchelgegend. Des Weiteren liegt ein chronischer Entzündungsprozess in den peripheren kleinsten Hautgefäßen – den sogenannten Kapillaren – vor. Frauen im mittleren Alter sind häufiger betroffen als Männer. Erstmals beschrieben wurde das Krankheitsbild vom französischen Dermatologen M.G. Milian im Jahre 1929. Synonyme sind Atrophia alba, weiße Atrophie, Capillaritis alba oder oberflächliche Arteriolitis.
Mit einem Abonnement erhalten Sie Zugriff auf alle Online-Inhalte.
Nutzen Sie Ihr Abonnement auch digital und profitieren Sie von der großen Fachartikelvielfalt . Der Zugang ist bei Ihrem Abonnement bereits enthalten und für Sie kostenlos.