19. Juli 2017
Studie
Fußdeformitäten und Diabetes
Der Diabetes mellitus zählt bereits zu den verbreitetsten Erkrankungen weltweit. Zu den Spätkomplikationen gehören Fußulzerationen, die entweder durch Nervenleitstörungen (Neuropathie) oder durch periphere arterielle Durchblutungsstörungen (Arteriopathie) entstehen können.
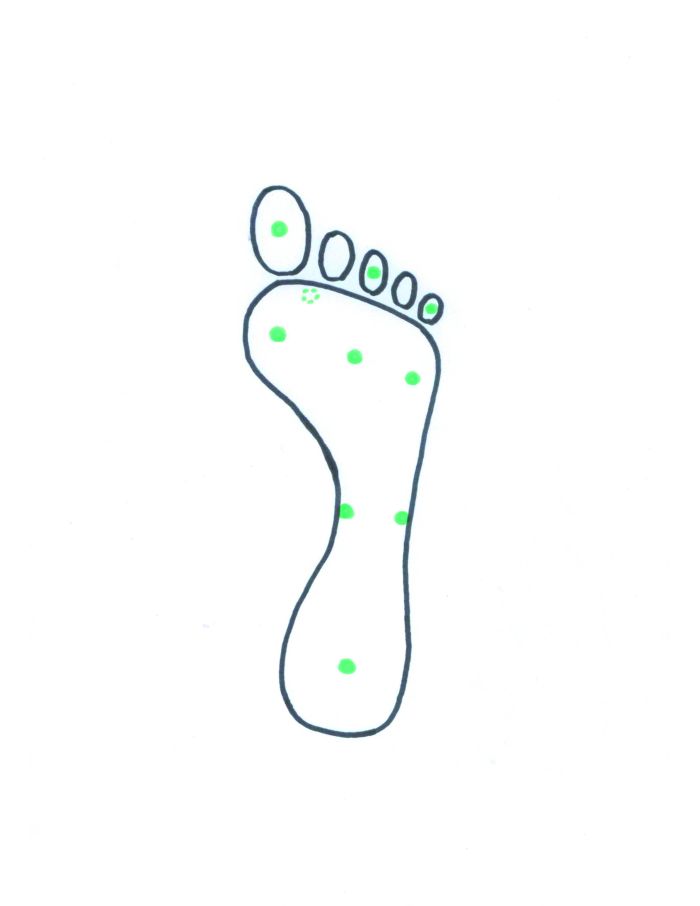
Grafik: Klaus Grünewald
1 Mit dem Semmes-Weinstein Filament (10 g) getestete Stellen: plantar der 1., 3. und 5. Zehe, plantar der 1. 3. und 5. Metatarsalköpfchen, am medialen und lateralen Fußgewölbe, plantar der Ferse und dorsal des Fußrückens zwischen der 1. und 2. Zehe (offener Kreis).
Inhalt
Anmelden und weiterlesen
Neu hier? Schließen Sie jetzt Ihr Abonnement ab!
Mit einem Abonnement erhalten Sie Zugriff auf alle Online-Inhalte.
Sie besitzen bereits ein Abonnement?
Nutzen Sie Ihr Abonnement auch digital und profitieren Sie von der großen Fachartikelvielfalt . Der Zugang ist bei Ihrem Abonnement bereits enthalten und für Sie kostenlos.





